– første stof med virkning direkte på defekten i DNA ved Huntingtons sygdom.
Det var en stor dag, da en HS-ramt d. 3. september i år fik behandling med det ny medicin-afprøvningsforsøg med stoffet, ISIS-HTT-Rx, som den første.
Hovedbestanddelen i ISIS-HTT-Rx er et kort stykke RNA (halv DNA-streng) designet, så det blokerer oversættelsen (translationen) af det forlængede HS-gen og dermed nedsætte mængden af det protein, der ellers bliver dannet ud fra DNA-koden.
Før dette studie har der været flere forsøg på bl.a. mus, som har fået sprøjtet aktivt stof direkte ind i de dybe kerner i hjernen. På mennesker er denne teknik naturligvis vanskelig, så i stedet sprøjtes ISIS-HTT-Rx ind i lænde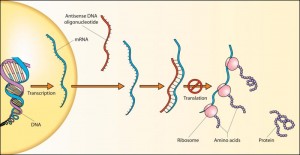 n i den væske, der løber rundt om hjerne og rygmarven (cerebrospinalvæsken); svarende til der, hvor flere af jer har fået lavet en rygmarvsvæskeprøve ved en såkaldt lumbalpunktur ved deltalgelse i dansk forskning. Levering af ISIS-HTT-Rx i cerebrospinalvæsken er fortsat kilde til bekymring blandt forskerne, da det ikke kan undgås, at en del medicin ikke når op i de dele af hjernen, hvor der forventeligt er mest brug for den – og spørgsmålet er, hvor meget, der når derop?
n i den væske, der løber rundt om hjerne og rygmarven (cerebrospinalvæsken); svarende til der, hvor flere af jer har fået lavet en rygmarvsvæskeprøve ved en såkaldt lumbalpunktur ved deltalgelse i dansk forskning. Levering af ISIS-HTT-Rx i cerebrospinalvæsken er fortsat kilde til bekymring blandt forskerne, da det ikke kan undgås, at en del medicin ikke når op i de dele af hjernen, hvor der forventeligt er mest brug for den – og spørgsmålet er, hvor meget, der når derop?
Samtidig med bekymring om det aktive stof når derhen, hvor der er mest brug for det, er der uvisheden om, hvor meget ISIS-HTT-Rx forsøgspersonerne kan tåle, og man prøver derfor at give forskellige doser i opdelte grupper af forsøgsdeltagerne samtidig med, at der laves flere undersøgelser inklusiv scanninger løbende under forsøget.
Medicinafprøvningsforsøget foregår i Canada, Storbritannien og Tyskland, og deltagere skal bl.a. pga. risikoen for bivirkninger bo tæt på de forsøgsansvarlige læger. Det er et såkaldt fase 1/2a medicinafprøvningsforsøg, hvilket betyder, at man primært måler sikkerheden ved behandling med ISIS-HTT-Rx i dette forsøg, og derfor heller ikke har planer om at have flere deltagere end 36 personer.
Det er planen, at der derefter skal laves nyt forsøg, hvor man måler effekten af ISIS-HTT-Rx på HS-symptoemerne, men denne næste fase i medicinafprøvningen kan ikke planlægges, før man har set nogle resultater fra det igangværende fase 1/2a forsøg.
Så foreløbig kan vi alle kun krydse fingre for, at dette første studie af genhæmning ved HS på mennesker bliver en succes, så man kan komme videre med udvikling af ny behandling.
Jeg ved godt, tålmodighed er en meget vanskelig, nærmest umulig dyd, når man har HS inde på livet, men det er desværre nødvendigt at vente, da den vigtige proces at gennemundersøge ny behandling, før det tages i brug, ikke kan gøres hurtigt.
Lena Hjermind